Les connaissances sur les médicaments évoluent tout au long de leur vie. C’est pourquoi la pharmacovigilance ne s’arrête jamais. Elle se base notamment sur les signalements d’événements indésirables émis par les laboratoires, les professionnels de la santé et les usagers.
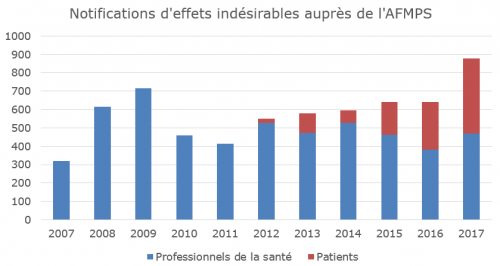
En 2017, l’AFMPS (Agence Fédérale des Médicaments et des Produits de Santé) a reçu 879 notifications d’effets indésirables provenant de professionnels de la santé et de patients, soit une augmentation de 37% par rapport à l’année 2016 (Figure 1). Ces chiffres sont encourageants et la progression est importante, mais le phénomène de sous-notification reste une préoccupation pour l’AFMPS. 879 notifications sur une année correspondent à 2 à 3 notifications par jour, pour l’ensemble du territoire belge.
Des patients de plus en plus pharmacovigilants
Chez les patients, l’évolution positive est constante et significative. La possibilité pour les patients de notifier existe depuis 2012 et cette année-là l’AFMPS recevait 23 notifications par des patients contre 411 en 2017. Chaque année les patients rapportent donc davantage les réactions qu’ils suspectent être dues à un médicament et les effets indésirables avérés auxquels ils sont confrontés.
Mais le constat est plus nuancé du côté des professionnels de la santé dont les notifications augmentent peu. La très grande majorité d’entre eux qui notifient des effets indésirables sont les médecins et les pharmaciens. Seules sept notifications d’effets indésirables provenaient de sages-femmes, dentistes et infirmiers. L’AFMPS, consciente de la contribution bénéfique que ces professionnels pourraient apporter, souhaite les encourager particulièrement à notifier à l’AFMPS tout effet indésirable suspecté et/ou avéré.
«La collaboration des patients et des professionnels de la santé via la notification d’effets indésirables est d’une valeur inestimable pour notre agence. C’est en travaillant ensemble que nous pourrons réaliser au mieux notre objectif commun: rendre plus sûrs tous les médicaments disponibles sur le marché», insiste Xavier De Cuyper, Administrateur général de l’AFMPS.
Initiative des pharmaciens européens
Associés aux programmes de pharmacovigilance et de réduction des risques iatrogènes menés au sein de l’Agence européenne du médicament, les pharmaciens d’officine européens ont publié un guide de bonnes pratiques dans ce domaine, basé sur les initiatives prises dans l’ensemble des États membres de l’Union européenne (UE).
Réalisé dans le cadre du Groupement pharmaceutique de l’Union européenne (GPEU), le représentant officiel des 400.000 officines européennes au sein des institutions communautaires, ce document contient aussi plusieurs propositions pour renforcer l’efficacité du travail officinal en matière de sécurité et de prévention. Avant tout, les pharmaciens européens souhaitent avoir accès à l’ensemble des dossiers et données électroniques de santé des patients, ce qui leur permettrait de s’intégrer beaucoup plus facilement dans la continuité des soins, mais aussi de réduire les risques d’effets indésirables, tout en détectant les erreurs de prescriptions, les interactions et les autres événements néfastes. Ils rappellent l’importance des nouvelles missions officinales pour réduire les risques, en particulier les «plans de médications», et appellent les pouvoirs publics à encourager le développement de ces pratiques à l’officine. Ils insistent aussi sur l’importance d’une bonne coopération entre tous les professionnels, et sur l’amélioration des formations en matière de sécurité pharmaceutique. En outre, les pharmaciens souhaitent que les ordonnances de prescriptions de médicaments hors AMM comportent plus d’informations, tant pour des raisons d’efficacité des traitements que de prévention des effets indésirables.
Le guide souligne l’engagement des pharmaciens européens, tant dans leurs pays qu’au niveau de l’UE, pour faire progresser la sécurité des délivrances et réduire les risques, en appelant tous les États à soutenir les officines pour leur permettre d’améliorer encore leurs actions dans ces domaines.
Les réseaux sociaux et pharmacovigilance
Le système actuel de pharmacovigilance souffre donc d’une sous-notification, liée à un manque de déclarations des professionnels de santé.
Outre des projets de facilitation des notifications (fiche accessible sur le site…), une nouvelle piste consisterait à rechercher, sur les réseaux sociaux et les forums de discussion, tout ce qui concerne des médicaments et leurs effets indésirables. Mais une question cruciale est la pertinence des informations qui peuvent être collectées. La capacité des patients à décupler un signal de pharmacovigilance a pu être observée de manière frappante ces dernières années, comme le démontrent les polémiques récentes créées sur la toile par les vaccins, des médicaments à base d'hormone thyroïdienne ou des sterilets. Ce sont les discussions de patients sur les réseaux sociaux, et plus particulièrement sur Facebook, qui paraissent systématiquement avoir précédé l’explosion de signalements d’effets indésirables auprès des institutions responsables. Il est donc très probable que l’influence des réseaux sociaux créée une sur-déclaration.
Plusieurs projets européens visant à déterminer comment une surveillance des réseaux sociaux pourrait être utilisée pour améliorer la pharmacovigilance, notamment en générant des signaux précoces d’alerte, sont en cours.
Le projet européen Web-RADR, qui réunit plusieurs laboratoires pharmaceutiques et la start-up Epidemico, propose ainsi d’analyser automatiquement les conversations des internautes sur Facebook et Twitter, mais aussi sur les réseaux sociaux de patients, afin de détecter des déclarations portant sur l’apparition d’effets secondaires. Ce type d’outil pourrait fournir des estimations précoces sur la nature et l’ampleur d’un effet secondaire et permettre aux laboratoires d’être mieux informés et d’améliorer leurs médicaments futurs.
En France, le projet de recherche Vigi4MED, financé par l’ANSM (l’Agence du médicament), analyse les commentaires des internautes sur des listes de médicaments prédéfinies: certains traitements suspendus du marché pour des raisons de pharmacovigilance et des médicaments sous surveillance renforcée ou faisant l’objet d’un plan de gestion des risques. Selon le Dr Cédric Bousquet, pharmacien et coordinateur du projet: «Vigi4MED permettra à l’ANSM de mesurer les bénéfices attendus et les coûts associés à une recherche proactive des signaux sur Internet.» Les partenaires produiront des recommandations concernant la meilleure façon d’exploiter les commentaires des patients dans les forums. La mise en place d’un processus de surveillance complémentaire pour la pharmacovigilance permettra de renforcer la place du patient dans le système de santé. «On ne fera jamais de l’imputabilité sur les réseaux sociaux, mais on va pouvoir trouver des corrélations, des signaux que l’on pourra tracer dans le temps», explique le spécialiste. Autre limite: on ne peut pas retourner vers le patient pour avoir plus d’informations.





















